几乎没有例外,哺乳动物IgG型抗体由两条完全相同的重链和两条完全相同的轻链通过双硫键连接在一起。每条链都包含一个物种特异的恒定区和一个可变序列区,此可变序列决定了抗原结合特性,例如亲和性和特异性(Amzel and Poljak, 1979)(图1)。
用于科学研究的抗体制剂通常是多克隆抗体或者单克隆抗体。
多克隆抗体由抗体分子混合物组成,由于其可变序列区的不同,因此它们的抗原结合特性也不同(图2)。多克隆抗体通常从免疫动物的血清中获得(Benner et al., 1981; Wootla et al., 2014)。
在动物免疫之后,激活的B细胞分化为浆细胞而最终生成大量可溶抗体。每一个高度特化的细胞都携带着分泌抗体的遗传信息(Benner et al., 1981; Wootla et al., 2014)。
为了收获最大量含有抗体的血清,宿主动物通常被牺牲,因此包含特定抗体遗传信息的浆细胞也会丢失。
因此,最终获得的抗血清是非常有限的资源。新的抗血清只能通过重新免疫更多动物获得。无论新材料验证的有多彻底,这样都不可避免地会导致一些批次间差异。
单克隆抗体包括完全相同的抗体分子,它们分享相同的抗原识别特性(图3)。
在1975年,杂交瘤技术被引进(Koehler and Milstein, 1975, Koehler and Mistein, 1976)。在这种方法中,抗体产出B细胞跟一个骨髓瘤细胞株融合在一起,从而生成所谓的可无限增殖的杂交瘤细胞。每个杂交瘤细胞克隆生成具有相同特性的同一抗体。这种技术的优点非常明显。新批次的抗血清不再需要每次从头开始进行广泛的表征和验证。实验方案也不再需要费力地去适应不断改变的抗体特性。即使随着时间的推移,科学界积累的验证数据依然可以保持它们的有效性。这样也使更多研究试剂具有更好的特性和价值。
然而,由杂交瘤技术生成的单克隆抗体仍然有一些限制。它们会经历遗传漂变,从而导致在特异性和亲和性上一些不期望的变化。总之,单克隆抗体的遗传信息是未知的,并且抗体特性的细微变化通过周密的细胞库已被最小化。某些杂交瘤细胞已被证明是不稳定的并且已被停止用来表达抗体。
重组抗体是通过使用已知的抗体编码基因,离体生成的单克隆抗体。一个抗体轻链和重链的编码序列可通过例如杂交瘤测序获得。序列可被克隆为表达载体,随后被转染入哺乳动物宿主细胞株进行抗体表达。最后稳定的转染细胞克隆可被生成,并且表达可被调整和优化(Kuhnert and Reinhart, 2016)。
一旦抗体被克隆,就有可能对其进行修饰。可变序列可被突变来改变结合特性或者亲和性。来自一个物种的恒定区可被来自另一物种的恒定序列代替,从而产生了嵌合重组抗体(Sahagan et al., 1986; Zalutsky et al., 1996)(图4)。这些通过基因工程改造的嵌合重组抗体保留了原抗体克隆的所有抗原识别特征(图5。
它们是在高度定义和控制的条件下生成的,具有最小批次间差异的无限资源。从细胞培养上清中纯化而来,所以不需要牺牲动物。序列是已知的,所以抗体不会由于遗传漂变而变化。相反的是,抗体工程有了更多的选择使一个抗体能去适应特定实验要求。Synaptic Systems可提供越来越多样的嵌合重组抗体,其恒定区来源于兔,豚鼠,大鼠,人类及鸡。他们都来自于我们表现优良的小鼠或兔单克隆抗体,并且可与常规物种特定二级抗体结合。因此,在我们手中,它们是非常有价值,可靠的具有卓越表现的科研工具。
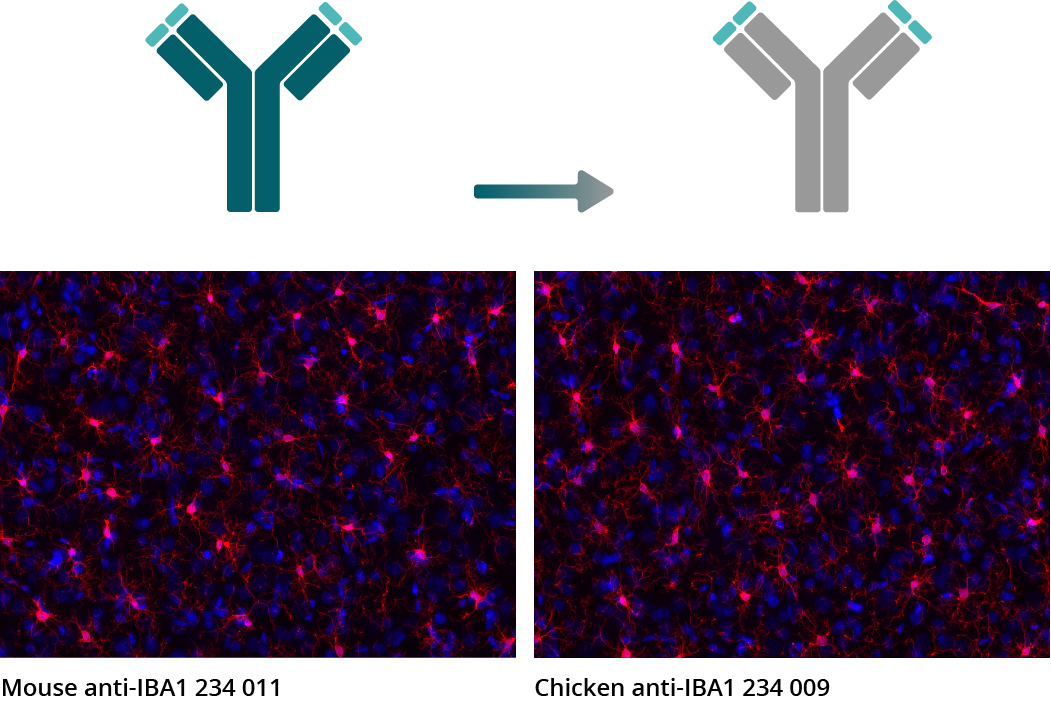
图5: 对比实验的代表性图片表明,嵌合重组抗体保留了原单克隆抗体的所有抗原结合特性。IHC图表显示了用单克隆小鼠抗IBA1抗体234 011和来源于IBA1抗体 234 011的嵌合重组鸡抗IBA1抗体234 009而获得的大鼠脑切片的免疫染色(IBA1 = 红色, DAPI = 蓝色)。
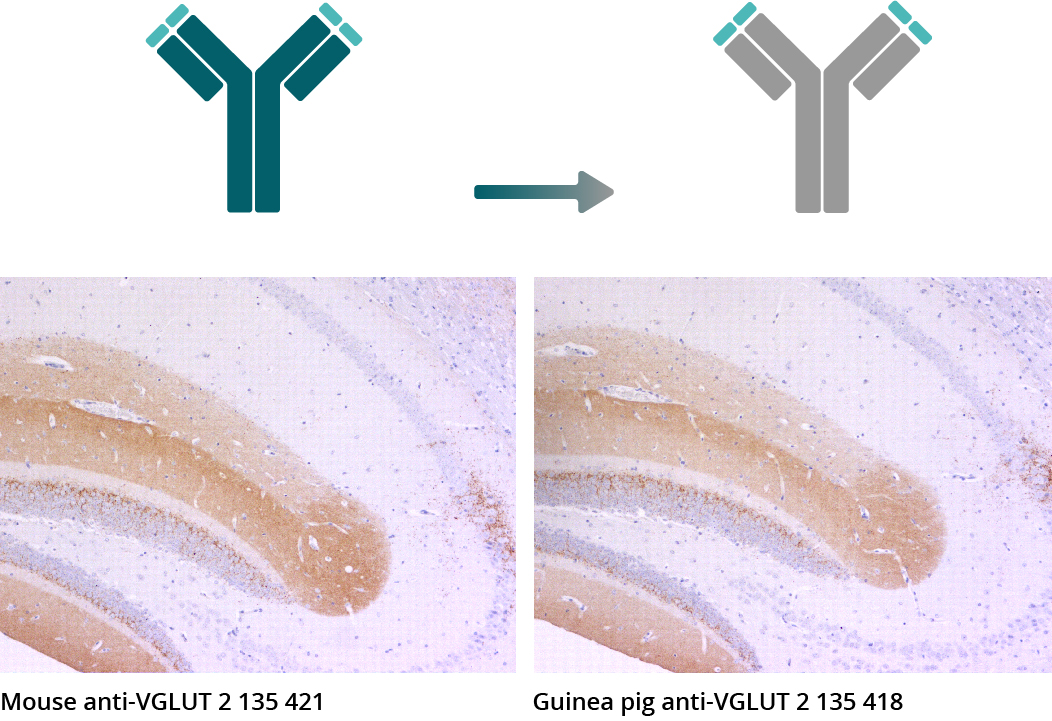
IHC-P 图表显示了利用单克隆小鼠抗VGLUT 2抗体135 421 和新兴的嵌合重组豚鼠抗VGLUT 2抗体135 418的小鼠脑切片的间接免疫染色(VGLUT 2 = 棕色, haematoxylin = 蓝色)。
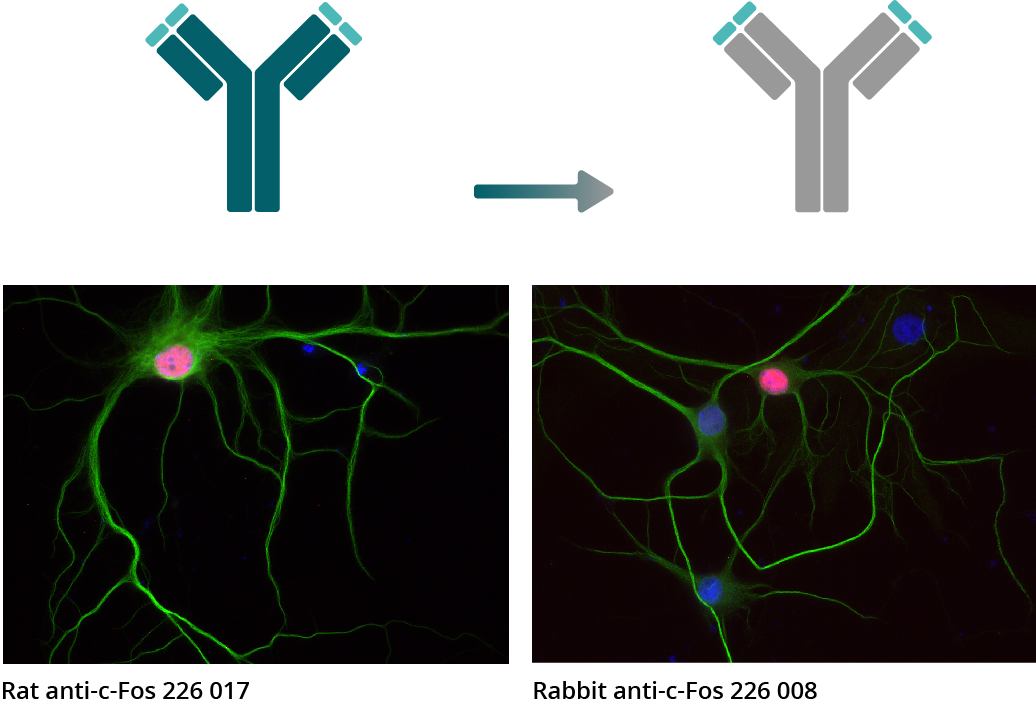
在 ICC 实验中, c-Fos 抗体 226 017 (大鼠单克隆抗体)和c-Fos 抗体 226 008 (兔重组抗体) 被用来对大鼠海马体神经细胞进行间接免疫染色(c-Fos = 红色, MAP 2 188 002 (多克隆兔抗血清) 和 MAP 2 188 011 (单克隆小鼠纯化IgG) = 绿色, DAPI = 蓝色)。
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
| 218 108 | Abeta-pE3, rabbit, monoclonal, recombinant IgGrecombinant IgG | Dot blot IHC IHC-P | 50 µg | US$420.00 | |
| 218 008 | Abeta38/40/42/43, rabbit, monoclonal, recombinant IgGrecombinant IgG | IHC IHC-P | 50 µg | US$420.00 | |
| 218 308 | Abeta38/40/42/43, Guinea pig, monoclonal, recombinant IgGrecombinant IgG | IHC IHC-P | 50 µg | US$420.00 | |
| 218 228 | Abeta40, rabbit, monoclonal, recombinant IgGrecombinant IgG | Dot blot IHC IHC-P ELISA | 50 µg | US$420.00 | |
| 218 708 | Abeta42, rabbit, monoclonal, recombinant IgGrecombinant IgG | Dot blot IHC IHC-P ELISA | 50 µg | US$420.00 | |
| N1582 | ALFA, mouse, monoclonal, recombinant IgGrecombinant IgG super-tight | WB ICC IHC | 100 µg | US$540.00 | |
| N1583 | ALFA, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB ICC | 100 µg | US$540.00 | |
| N1584 | ALFA, Guinea pig, monoclonal, recombinant IgGrecombinant IgG | WB ICC | 100 µg | US$540.00 | |
| 128 208 | α Synuclein, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB ICC IHC IHC-P | 50 µg | US$420.00 | |
| 302 008 | α-Tubulin, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB ICC IHC | 100 µg | US$420.00 | |
| 302 209 | α-Tubulin, chicken, monoclonal, recombinant IgYrecombinant IgY | WB ICC IHC IHC-P | 50 µg | US$420.00 | |
| 302 211 | α-Tubulin, mouse, monoclonal, recombinant IgGrecombinant IgG | WB IP ICC IHC IHC-P ELISA | 100 µg | US$420.00 | |
| 302 218 | α-Tubulin, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB ICC IHC IHC-P | 50 µg | US$420.00 | |
| 302 308 | α-Tubulin, Guinea pig, monoclonal, recombinant IgGrecombinant IgG | WB ICC IHC IHC-P | 50 µg | US$420.00 | |
| 429 008 | Aquaporin4, rabbit, monoclonal, recombinant IgGrecombinant IgG | IP ICC IHC IHC-P IHC-Fr IHC-G | 50 µg | US$420.00 |
Amzel and Poljak, 1979: Three-dimensional structure of immunoglobulins. PMID: 89832
Benner et al. 1981: Immunoglobulin isotype expression. II. Frequency analysis in mitogen-reactive B cells. PMID: 6975718
Wootla et al., 2014: Polyclonal and monoclonal antibodies in clinic. PMID: 24037837
Koehler and Milstein, 1975: Continuous cultures of fused cells secreting antibody of predefined specificity. PMID: 1172191
Koehler and Milstein, 1976: Derivation of specific antibody-producing tissue culture and tumor lines by cell fusion. PMID: 825377
Kuhnert and Reinhart, 2016: Advances in recombinant antibody manufacturing. PMID: 26936774
Shahagan et al., 1986: A genetically engineered murine/human chimeric antibody retains specificity for human tumor-associated antigen. PMID: 3088107
Zalutsky et al., 1996: Chimeric anti-tenascin antibody 81C6: increased tumor localization compared with its murine parent. PMID: 8832699