· 简介
· 神经丝的结构、成分和组合
· 转录后修饰(PTMs)和神经丝(NFs)功能
· 神经丝功能
· 神经丝作为标记蛋白
· 产品
· 参考文献
神经的细胞骨架由微管、微丝和神经丝(NFs)组成。神经丝属于中间纤维(Ifs),其名称来源于8-10 nm的特征直径,介于6 nm的肌动蛋白微丝和24 nm的微管之间(Lee and Cleveland, 1996)。它们的长度变异性极大,可以达到几µm。神经丝仅存在于神经元中,是哺乳动物轴突中最丰富的结构成分,它们可决定轴突的形状和直径。轴突的直径对神经传导速率是一个重要的参数(Yuan et al. 2012, Laser-Azogui et al., 2015)。
成熟杂聚神经丝的主要成分是神经丝L (NF-L),神经丝M (NF-M) 和神经丝H (NF-H),它们都属于类型IV中间纤维(图1)。L、M 和H分别代表低 (约等于70 kDa)、中(约等于160 kDa)和高(约等于200 kDa)不同的分子量(Lee and Cleveland, 1996)。由于它们的高含量带电氨基酸和高度转录后修饰,SDS PAGE中表观分子量与它们的理论预测值不同(图2)。除NF-L、NF-M和NF-H之外,神经丝也可包含α-丝联蛋白,是另一种类型IV中间纤维(Yuan et al., 2006)。然而,一种类型III中间纤维,外周蛋白,只存在于外围神经系统(PNS)中的神经丝中(Yuan et al., 2012) (图1)。

图1:神经丝蛋白的结构域。所有的神经元中间纤维由一个N端头域,一个包含1a、1b和2a/b的螺旋形核心,和可变的C端尾域组成(Laser-Azogui et al., 2015)。
巢蛋白,作为另一种神经元中间纤维,在中枢神经系统发育时仅可被早期胚胎、神经上皮干细胞短暂表达(Lee and Cleveland, 1996)。然后此蛋白在分化和被其它组织特异性中间纤维取代之时会下调。所有的神经元中间纤维共享相同的结构域,具有一个氨基酸端头域、一个包含1a、1b和2a/b的螺旋状核心的杆域和一个可变的羧基端尾域(图1)(Laser-Azogui et al., 2015)。
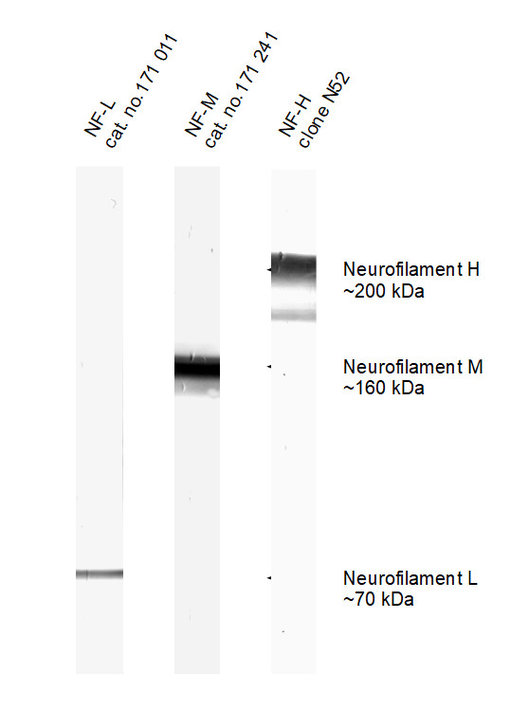
图2:在小鼠脑匀浆中检测神经丝L、 M和H (用碱性磷酸酶染色)。
实际观察到的分子量与理论值显著不同:
NF-L: 61.5 kDa
NF-M: 95.9 kDa
NF-H: 117 kDa
图2:在小鼠脑匀浆中检测神经丝L、 M和H (用碱性磷酸酶染色)。
实际观察到的分子量与理论值显著不同:
NF-L: 61.5 kDa
NF-M: 95.9 kDa
NF-H: 117 kDa
神经丝组成的第一步中,NF-L或者α-丝联蛋白可通过平行结合保守杆域,与其它神经中间纤维二聚形成卷曲螺旋二聚物。两个二聚物以错列反向平行的方式组装形成四聚物。此四聚物经常被称为神经丝的基本子单元或者构件。它们一起形成单位长度的细丝(ULFs),然后通过轴向聚集组成未成熟细丝(图3)。在最后一步成熟时,径向的压缩会形成带有灵活C端尾部的瓶刷状细丝来修饰细丝表面(Laser-Azogui et al., 2015) (图3)。
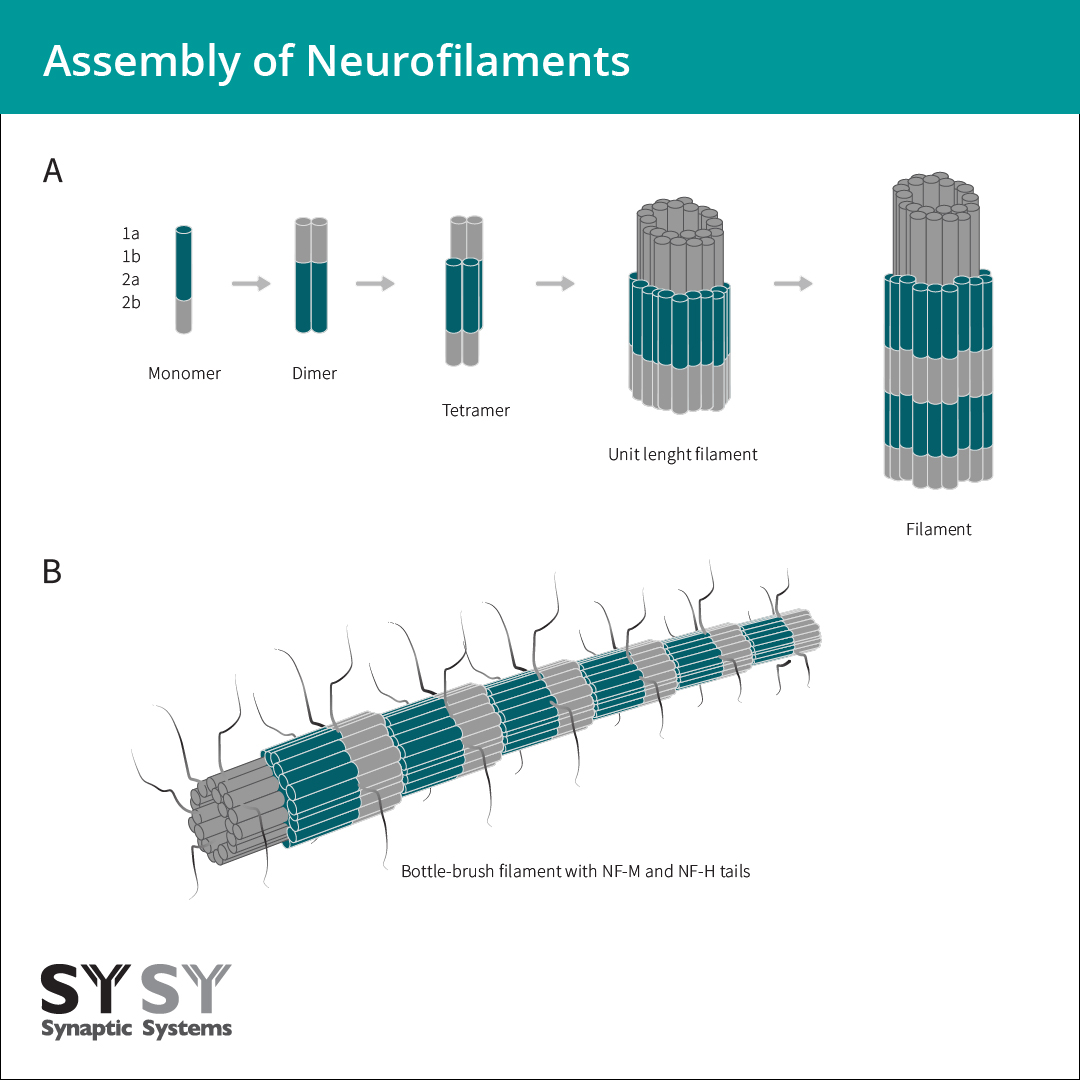
图3:神经丝组成开始于NF-L或者α-丝联蛋白与其它神经元中间纤维蛋白平行二聚,形成卷曲螺旋二聚体。两个卷曲螺旋二聚体以半错列方式组装形成一个反平行四聚物。四聚物横向聚合而形成一个单位长度细丝(ULF)。单位长度细丝的轴向聚集生成大约16 nm直径的未成熟细丝。在随后的径向压缩步骤中,分子丝紧密地排列在一起,组成最后的10 nm带有灵活C端尾部的“瓶刷状”细丝来修饰细丝表面(Laser-Azogui et al., 2015)。
根据它们的数量和排列密度,组合的神经丝是主要的结构成分,决定了轴突直径,是影响轴突脉冲传播的重要因素(Laser-Azogui et al., 2015)。
在发育的早期,轴突是相当狭窄的进程,包含相对较少的神经丝。随着发育,专门的轴突逐渐具有髓鞘,并且同时累积了更多的神经丝,引起多达5-10倍的径向生长。一个大的具有髓鞘的轴突在一个横切面中可能包含数以千计的神经丝。不同的转录后修饰事件也参与到了这些组合和稳定过程(Fenn et al., 2018)。
神经丝属于最高度磷酸化的神经元蛋白(Luedemann et al., 2005)。尤其,NF-L和α-丝联蛋白的N端头域的短暂磷酸化状态,主要发生在细胞体中,可严重影响神经丝聚合物组合,分解和轴突输送。
NF-M和NF-H具有长C端尾域,包含许多转录后修饰位点,成熟轴突中的高度磷酸化可影响轴突的口径和稳定性 (Snider and Omary, 2014)。在头域和尾域之间的已划分的神经丝磷酸化作用可被紧密调控,神经丝磷酸化作用的下调与某些神经变性的疾病相关(Binukumar et al., 2013)。
神经丝也是糖基化的,但其转录后修饰的确切功能角色还未被成功解开。然而,反常的糖基化模式与某些神经变性疾病有关,如阿尔兹海默症(AD)(Deng et al., 2008)或者肌萎缩侧索硬化症(ALS)(Luedemann et al., 2005)。
根据它们的数量和排列密度,组合的神经丝是主要的结构成分,决定了轴突直径,是影响轴突脉冲传播的重要因素。
在发育的早期,轴突是相当狭窄的进程,包含相对较少的神经丝。随着发育,专门的轴突逐渐具有髓鞘,并且同时累积了更多的神经丝,引起多达5-10倍的径向生长。一个大的具有髓鞘的轴突在一个横切面中可能包含数以千计的神经丝。不同的转录后修饰事件也参与到了这些组合和稳定过程。
神经丝仅存在于神经元中,属于成熟神经系统中最早可识别的特征(Ulfig et al., 1997)。由于神经丝可在轴突中大量累积,在多种应用中,如免疫细胞化学(ICC)(图4a),免疫组织化学(IHC 和IHC-P)(图 4b、c和d)和免疫蛋白印迹(WB)(图2),它们对于此细胞区室是有价值的通用标记蛋白。
外周蛋白可用来专门从外围神经系统(PNS)和中枢神经系统(CNS)中鉴别神经元(Yuan et al., 2012 b) (图4 c和d)。
由于神经丝水平在神经轴突受神经变性或创伤的疾病损害后会上升,因此神经丝也可用作血液和脑脊液(CSF)中有价值的生物标记物(Khalil et al., 2018)。
这种神经轴突损害也可在组织学水平上被观察到。在中风模型中,在引发局部缺血后,神经丝完整性的减少会变得明显。在完整神经元中抗体表位被掩蔽,从而变得更容易接近,在受缺血影响的脑部会引起更强的免疫反应活性(Mages et al., 2018)。
Synaptic Systems针对不同种类神经丝,提供种类广泛的多克隆和单克隆抗体,涵盖了以上提到的大部分应用
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
| 171 008 | Neurofilament L, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB ICC IHC IHC-P | 50 µg | US$420.00 | |
| 171 011 | Neurofilament L, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P IHC-Fr ExM DNA-PAINT | 100 µg | US$420.00 | |
| 171 014 | Neurofilament L, Guinea pig, polyclonal, antiserumantiserum | WB IP ICC IHC-P | 100 µl | US$370.00 | |
| 171 202 | Neurofilament M, rabbit, polyclonal, antiserumantiserum | WB ICC IHC IHC-P | 200 µl | US$360.00 | |
| 171 203 | Neurofilament M, rabbit, polyclonal, affinity purifiedaffinity | WB ICC IHC IHC-P | 50 µg | US$460.00 | |
| 171 204 | Neurofilament M, Guinea pig, polyclonal, antiserumantiserum | ICC IHC IHC-P | 100 µl | US$370.00 | |
| 171 206 | Neurofilament M, chicken, polyclonal, affinity purifiedaffinity | ICC IHC | 50 µg | US$385.00 | |
| 171 211 | Neurofilament M, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P | 100 µg | US$420.00 | |
| 171 221 | Neurofilament M, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P | 100 µg | US$420.00 | |
| 171 231 | Neurofilament M, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P DNA-PAINT | 100 µg | US$420.00 | |
| 171 241 | Neurofilament M, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P DNA-PAINT | 100 µg | US$420.00 | |
| 171 248 | Neurofilament M, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB ICC IHC IHC-P | 50 µg | US$420.00 | |
| 424 004 | Peripherin1, Guinea pig, polyclonal, antiserumantiserum | ICC IHC IHC-P | 100 µl | US$370.00 |
Binukumar et al., 2013: Topographic regulation of neuronal intermediate filaments by phosphorylation, role of peptidyl-prolyl isomerase 1: significance in neurodegeneration. PMID: 23793952
Deng et al., 2008: Regulation between O-GlcN acylation and phosphorylation of neurofilament-M and their dysregulation in Alzheimer disease. PMID: 17687114
Fenn et al., 2018: Axonal neurofilaments exhibit frequent and complex folding behaviors. PMID: 29683261
Laser-Azogui et al., 2015: Neurofilament assembly and function during neuronal development. PMID: 25635910
Khalil et al. 2018: Neurofilaments as biomarkers in neurological disorders. PMID: 30171200
Lee and Cleveland, 1996: Neuronal intermediate filaments. PMID: 8833441
Luedemann et al., 2005: O-Glycosylation of the tail domain of neurofilament protein M in human neurons and in spinal cord tissue of a rat model of amyotrophic lateral sclerosis (ALS). PMID: 16006557
Mages et al., 2018: Impaired Neurofilament Integrity and Neuronal Morphology in Different Models of Focal Cerebral Ischemia and Human Stroke Tissue: PMID: 29967576
Snider and Omary 2014: Post-translational modifications of intermediate filament proteins: mechanisms and functions. PMID: 24556839
Yuan et al., 2006: α-internexin is structurally and functionally associated with the neurofilament triplet proteins in the mature CNS. PMID: 17005864
Yuan et al., 2012 a: Neurofilaments at a Glance. PMID: 22956720
Yuan et al., 2012 b: Peripherin is a subunit of peripheral nerve neurofilaments: Implications for differential vulnerability of CNS and peripheral nervous system axons. PMID: 22723690