原癌基因c-fos属于立早基因(IEGS),可快速及短暂地在脑中表达 (Herrera and Robertson, 1996)。它可被多种刺激物诱导,通常用作神经元激活的标记物 (Morgan et al., 1987; Gaiddon et al., 1996; Chowdhury et al., 2000; Gallo et al., 2018; Wakhloo et al., 2020)。像许多其它立早基因一样,c-Fos是一种转录因子。它与c-Jun结合为异质二聚体,结合到AP-1结合位点 (图1),可增强许多参与增殖、分化、细胞凋亡或炎症其它基因的表达 (Ye at al., 2014)。
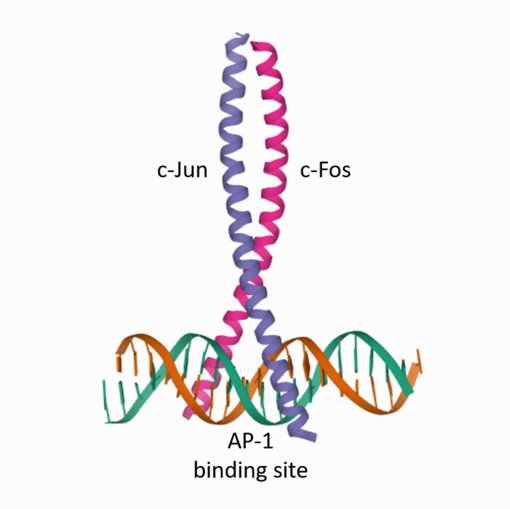
图1:异质二聚体bZIP转录因子c-Fos/c-Jun与DNA结合的图例说明 (改编自Glover and Harrison, 1995 and PDB 1FOS)。
图1:异质二聚体bZIP转录因子c-Fos/c-Jun与DNA结合的图例说明 (改编自Glover and Harrison, 1995 and PDB 1FOS)。
动物处理:当计划动物c-Fos试验时,你应该意识到技术缺陷会影响到你的研究成果。例如,你应该考虑到c-Fos表达与时间有关,易受压力影响,可在几分钟后就检测到 (Herrera and Robertson, 1996)。重要的是要考虑到许多因素,如动物处理本身(例如针注射)或者在黑暗时期暴露于光下(节律激活)可影响c-Fos表达 (Asanuma and Ogawa, 1994; Herrera and Robertson, 1996)。因此,试验必须精确计划和实施,并须有合适的对照组,以避免假阳性结果。
IHC实验方案:另一点你应该关心的是你的免疫组织化学(IHC)实验方案。似乎c-Fos阳性细胞总数目取决于阈值。许多参数如:组织储存条件、切片方法(低温恒温器或振动切片机)、染色参数(例如孵育温度)、信号增强试剂,尤其是初级抗体的选择都可影响c-Fos阳性细胞数目的检测 (Berghorn et al., 1994; Werner et al., 1996; Mayer and Bendayan, 2001)。
c-Fos抗体:初级抗体间的特异性、敏感性和信噪比都不同,而这些特性会影响你试验的结果。因此,我们的目标在于为科学研究和试验重复性提供高特异性和一致性的c-Fos抗体。由于单克隆抗体与多克隆抗体相比拥有多种优势,因而我们开发了一种新的单克隆重组兔抗-c-Fos抗体。
抗体共享一种由两条重链和两条轻链组成的常见结构(图2)。所有重链和轻链包含物种特异性恒定区和负责目标识别的可变序列 (Davies and Metzger, 1983)。
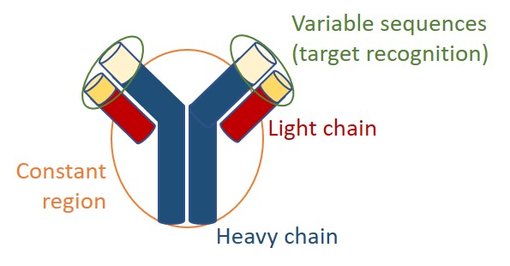
图2:抗体结构。抗体由两条重链和两条轻链组成。所有重链和轻链包含物种特异性恒定区和负责目标识别的可变序列。
图2:抗体结构。抗体由两条重链和两条轻链组成。所有重链和轻链包含物种特异性恒定区和负责目标识别的可变序列。
这种高度定义的单克隆重组抗体可在受控条件下作为无限资源在哺乳动物细胞中表达,且批次间差异最小。它在我们的测试标准应用中表现卓越,等同于或甚至好于我们最好的兔多克隆c-Fos批次(图4)。多克隆兔抗c-Fos抗体226 003极易受试验条件改变的影响(例如,IHC实验中孵化温度可影响信号强度),而单克隆重组兔抗c-Fos抗体226 008在不同试验设置下染色结果依然稳健,因此是你试验的最好选择。
随着时间推移,这种单克隆抗体将会被用于很多不同应用中,所有收集的信息都将有助于更好地描述此研究试剂。与多克隆抗体相反,这些信息不断积累,永远不会丢失,使这种研究试剂成为您手中越来越有价值和可靠的工具。
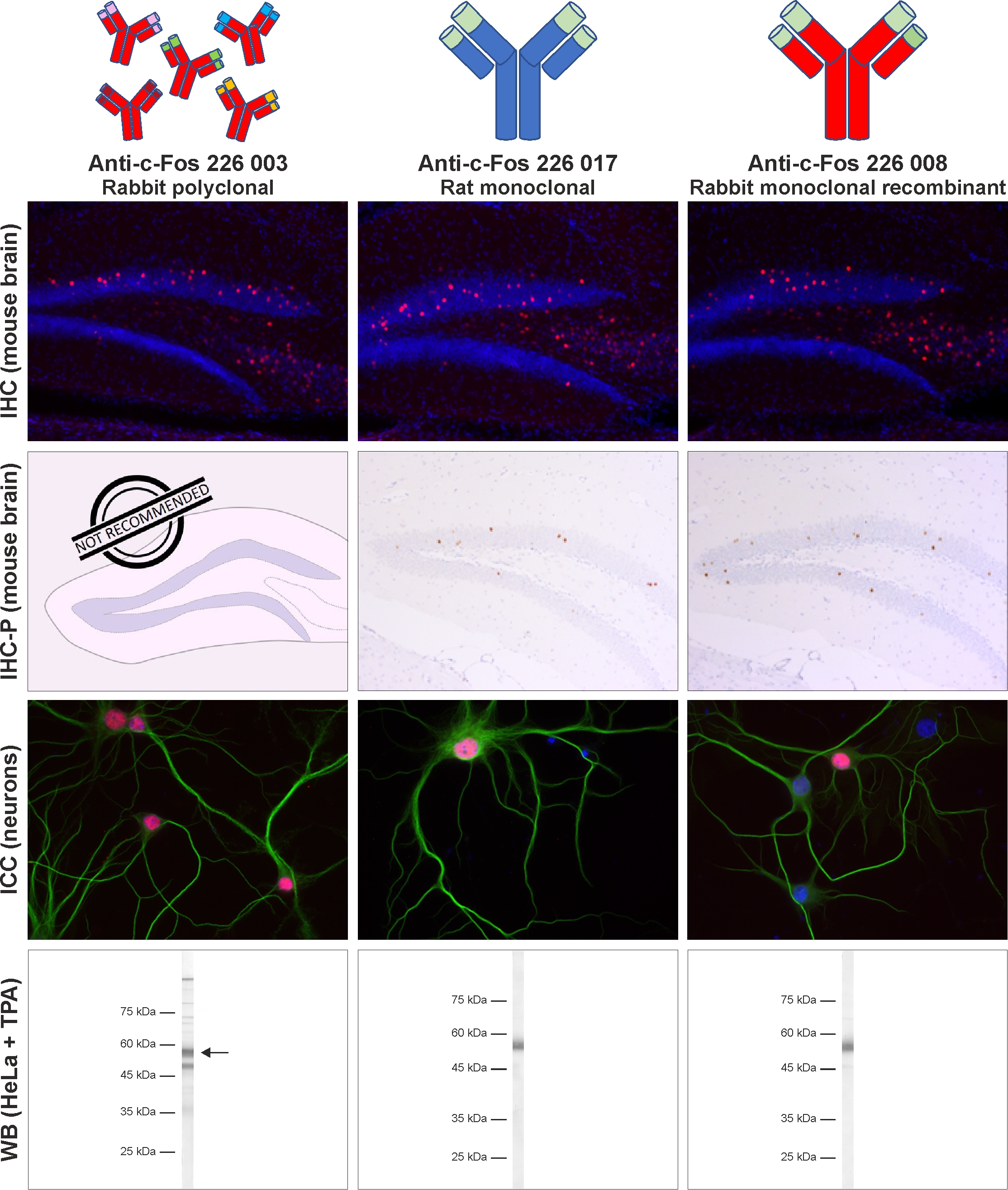
图4:单克隆重组兔抗- c-Fos抗体226 008在我们所有的标准应用中都表现优异。重组兔抗- c-Fos抗体226 008与单克隆大鼠抗c-Fos抗体226 017和多克隆兔抗c-Fos抗体226 003在相同试验条件下相比。在IHC和IHC-P试验中,c-Fos抗体可用于小鼠和大鼠海马体切片的间接免疫染色(小鼠切片显示;IHC:c-Fos = 红色,DAPI = 蓝色;IHC-P:c-Fos = 棕色,苏木精 = 蓝色)。在ICC试验中,c-Fos抗体可用于大鼠海马体神经元的间接免疫染色(c-Fos = 红色,MAP 2 188 011/188 002 = 绿色,DAPI = 蓝色)。在免疫印迹试验中,c-Fos可从TPA刺激的HeLa细胞的核提取物中检测到(检测方法:AP染色)。